血液系统是维持机体生命活动最重要的系统之一,能够为机体提供氧气和营养物质,通过物质交换维持内环境的稳态,同时为机体提供免疫防御和保护。血细胞是血液的重要组成成分,可以分为髓系和淋系两大类,其中髓系细胞包括红系细胞、巨核系细胞、粒系细胞和单核系细胞,淋系细胞主要包括T淋巴细胞、B淋巴细胞和自然杀伤细胞(natural killer cell, NK)。所有成熟血细胞均起源于造血干细胞(hematopoietic stem cells, HSCs),一群具有自我更新及分化潜能的多能干细胞。造血干细胞及各类血细胞产生、发育及成熟的过程称为造血过程,该过程起始于胚胎发育早期并贯穿整个生命过程,任一阶段出现问题都会导致血液疾病的发生。目前对于恶性血液疾病,如白血病,最常用的方法是造血干细胞移植,其治疗效果很大程度上依赖于移植细胞的质量及数量。因此体外诱导造血干细胞产生并维持其干性将成为非常重要的解决办法之一。研究体内造血干细胞的发育过程及其分子调控机制,能够为体外获得大量可移植的造血干细胞提供理论依据。
在脊椎动物中,造血干细胞产生于胚胎期主动脉-性腺-中肾区域。主动脉中一类具有生成血细胞功能的内皮细胞,称为生血内皮,经过内皮-造血转换过程(endothelial-hematopoietic transition, EHT)生成造血干细胞。在此过程中,一部分腹侧动脉内皮细胞的内皮特性逐渐减弱,并发生形态变化,由扁平的内皮细胞形态逐渐收缩凸起,同时内皮细胞之间的紧密连接逐渐松弛,脱离动脉内皮后进入血液循环。随后造血干细胞向胎肝(小鼠和人)或尾部造血组织(斑马鱼)迁移并进行扩增,向胸腺迁移发育为淋系细胞;最后,造血干细胞经过血液循环迁入骨髓(小鼠和人)或肾髓(斑马鱼)定居并进行自我更新与分化,维持终生造血平衡。经过几十年的研究与探索,人们对于造血干细胞的体内发育和体外诱导分化步骤已有了基本的了解,但对整个过程中动态调控机制的认识仍不完善,尤其对于表观遗传修饰在脊椎动物造血干细胞发育过程中的作用更是知之甚少。
RNA作为细胞内重要的信息分子和调控分子,在各种生物学调控过程中发挥关键作用。与DNA和组蛋白相似,RNA上也存在多种化学修饰。截至目前,已经发现百余种RNA修饰,其中甲基化修饰约占80%,这些转录后的修饰在很大程度上丰富了RNA的功能。其中,N6-甲基腺嘌呤(N6-methyl-adenosine, m6A)依赖的RNA甲基化是真核生物mRNA中最普遍的甲基化形式。m6A最早是1955年在细菌的DNA中发现的,随后在多个物种包括细菌、酵母、小麦以及哺乳动物的RNA中也被发现。但是受限于当时的分子生物学技术,m6A修饰过程的研究一直没有进展。直到90年代初m6A体外甲基化系统的建立以及首个甲基转移酶的分离纯化,促进了该项研究进一步的突破。随着高通量测序技术的发展,m6A在mRNA中的分布特点及识别位点逐渐清晰。通过对小鼠和人类细胞系或组织进行m6A测序发现,m6A的分布在哺乳动物中是高度保守的,其主要分布在mRNA的终止密码子(stop codon)、3°-UTR和长外显子区域,其核心序列主要为RGACH(R=G/ A, H=A/C/U)。
从2011年开始,各研究组对m6A甲基化相关蛋白的研究使m6A的发生过程越来越明确。转录后,mRNA前体在m6A甲基转移酶复合体(由METTL3、METTL14和WTAP组成),也称作“写码器(writer)”的作用下发生甲基化。这一过程在m6A去甲基化酶,也称作“消码器(eraser)”,如FTO和ALKBH5的作用下是可逆的。甲基化的mRNA可以被多个m6A- RNA结合蛋白,也称作“读码器(Reader)”识别并发挥不同的作用。3°-UTR附近被甲基化的mRNA在细胞核内被YTHDC1或HNRNPA2B1识别,介导剪接或microRNA的加工;也可以转移到细胞质内被YTHDF1或YTHDF2识别,介导mRNA翻译或稳定性。虽然m6A在5°-UTR区域的分布较少,但也发挥着非常重要的作用。在应激状态下,如热激刺激,5°-UTR的m6A修饰可以调控帽子结构非依赖性(cap-independent)的翻译过程,而且核内YTHDF2的参与可以防止FTO对m6A修饰的清除。除此之外,m6A修饰还参与mRNA其他代谢过程,如mRNA转录、定位及运输,但是这些生物学过程究竟是如何被精细调控、以及还有哪些“读码器”参与这些过程仍需要进一步研究。
近年来,对于m6A修饰参与的生命活动过程也有进一步研究,如m6A能够调控机体的节律、肥胖、精子发生以及胚胎干细胞命运决定,但是这些作用都依赖于离体或细胞系的研究。目前,对于m6A修饰在发育及正常生理状态下体内生物学作用的研究,已成为生命科学热门研究领域之一。近期,Nature杂志连续发文报道了m6A在斑马鱼早期发育、果蝇性别决定以及哺乳动物中T细胞稳态中的功能。自此,人们对于m6A修饰已经有了初步了解和认识,但是该修饰的生物学功能以及其作用机制仍有待深入探索和挖掘。
本研究团队前期合作发现斑马鱼中的m6A甲基转移酶复合体成分,该研究结果于2014年2月发表于Cell Research(doi:
该工作首次揭示mRNA m6A甲基化修饰在脊椎动物造血干细胞命运决定中的调控机制,丰富了对m6A甲基化修饰在正常生理状态下生物学功能的认识,对推动该领域研究具有重要意义。同时,上述成果不仅首次阐释RNA表观修饰在血液发育中的关键作用,还将为体外诱导扩增造血干细胞提供理论指导。该项研究成果以“m6A modulates haematopoietic stem and progenitor cell specification”为 题于2017年9月6日正式发表于Nature (doi:10.1038/nature23883)。
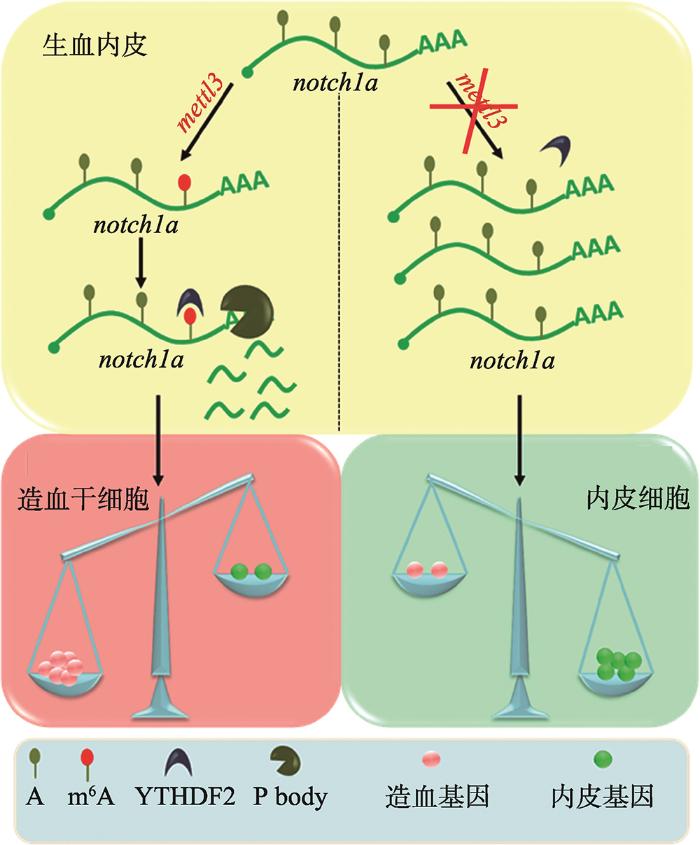
图1
图1
m6A修饰调控造血干细胞产生模式图
甲基转移酶METTL3通过m6A修饰决定notch1a的mRNA水平,进而调控内皮-造血转化过程。
Fig. 1
Schematic representation of the role of m6A methylation in HSPC fate determination during EHT via METTL3-notch1a